RNA生物学是近年来在癌症研究领域备受关注亦是发展迅速的一个研究方向。在真核细胞中,RNA既可以“赤裸”的存在,也可以“穿着”蛋白质的外衣。与RNA结合的蛋白质被称为RNA结合蛋白(RBP)。RBP被证实具有强大的基因表达调节能力;在RNA的合成、选择性剪接、修饰、转运、定位和翻译等生命过程都起着关键的作用。因此,聚焦于RBP的研究(比如哪些RBP与哪些特定的RNA发生结合进而影响其功能,尤其是与癌症相关的RBP如何调控致癌基因和抑癌基因的转录本活性等),对我们进一步了解癌症发生发展的机制和寻求新的治癌靶点有很大的帮助。
近日,湖南大学生物学院张定校教授受Cellular and Molecular Life Sciences杂志邀请,对RBM38(一种研究较多的RBP)在癌症中的作用及其机制进行了详细地介绍(图1A)。大多数研究表明RBM38在乳腺癌,肝癌,结直肠癌,肾癌,胃癌和其他癌症中均发挥了抑癌基因的作用。RBM38可以靶向mRNA 3'-UTR中富含AU/U或CU的元件(ARE)并与之结合,最终通过三种方式来调节细胞行为。一方面,RBM38可通过调节mRNA的稳定性来上调基因的表达(比如p53家族相关基因p21/p73,核受体ER/PR,抑癌基因PTEN和肿瘤转移抑制基因ZO-1/ STARD13等);一方面,RBM38可通过结合并降低mRNA的稳定性来抑制致癌基因的表达(比如MYC和MDM2);另一方面,RBM38还可抑制p53和缺氧诱导因子HIF1α的蛋白质翻译。有趣的是,我们还发现RBM38不仅受p53基因家族的转录调控,反过来也会通过不同的分子方式来影响p53家族各成员的表达,两者之间存在着复杂的负反馈调控网络(图1B)。虽然大部分的RBP都是在转录本RNA水平调控基因的表达,但转录后的调控(即翻译后修饰)也是影响蛋白质功能的主因之一。磷酸化是最普遍的一种蛋白质修饰。特别注意的是,RBM38 S195位点的磷酸化修饰会“反向性”地改变其生物活性(野生型RBM38抑制p53的翻译,而S195磷酸化的RBM38则会促进p53的翻译)。最后,由于RBM38的抑癌作用以及其与p53的紧密关系,RBM38已经成为了一个新的治癌的靶点(比如通过表观遗传学途径上调RBM38的表达,或是抑制其活性从而促进抑癌基因p53的表达等)。
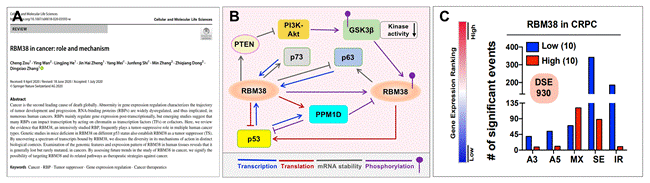
图1. RBM38在癌症中的作用机理。(A)发表的文章截图。(B) RBM38与p53家族成员之间的复杂调节网络。(C) RBM38与治疗抵抗的恶性前列腺癌有关:其高表达会大幅度地抑制癌症RNA的剪切。
张教授团队聚焦该基因的起因源自于其课题组前期的研究发现(Nat Commun 2020,http://bio.hnu.edu.cn/info/1095/3522.htm)。RBM38是一个剪接因子,但目前对于它调控RNA剪接功能的报道很少。我们课题组发现RBM38可能在前列腺癌(PCa)中起剪接抑制因子的作用:其表达水平的高低与癌症样本中RNA异常剪接的数量成反比(图1C)。我们正在进一步研究该基因在恶性前列腺癌进展(包括药物治疗抗性与癌症转移)中的作用。我们将运用一系列细胞水平的体外实验,并结合动物水平的体内实验来检验RBM38是否在前列腺癌中也发挥了抑癌基因的作用;再利用RNA-seq和RIP-seq等手段鉴定RBM38的全基因组靶向底物;进一步地揭示RBM38调控PCa特异性RNA剪接异常的分子机制,为目前无药可愈的恶性前列腺癌治疗开辟新途径。
该文章的共同第一作者为邹城(博士后)和万莹(研二),张定校教授为本文的通讯作者。在该文的修回过程中得到了生物学院史俊峰教授,梅杨教授和郑金海副教授的大力支持,在此表示感谢!
原文链接:https://link.springer.com/article/10.1007/s00018-020-03593-w
