近年来,基于核酸适体(Aptamer)构建的多价激活式诊疗一体化DNA纳米器件在癌症诊断和治疗领域受到了广泛关注。但是,目前报道的大多数激活式多价Aptamer功能化DNA纳米诊疗器件是通过体外组装获得,一方面因为尺寸较大易被网状内皮系统清除,另一方面难以精确控制DNA纳米诊疗器件中Aptamer修饰密度以及空间定向,而这两个因素都会在很大程度上影响多价Aptamer功能化DNA纳米诊疗器件的靶标结合力。近日,王柯敏/何晓晓团队在生物医学1区杂志《Theranostics》(2020 IF: 11.556)上发表论文,报道了一种肿瘤酸性微环境触发的“三臂Aptamer纳米爪”型(TA-aptNC)多价Aptamer功能化DNA纳米器件原位组装策略用于增强肿瘤成像对比度和高效抑制肿瘤生长研究。该策略获得的TA-aptNC具有精确可控的表面配体修饰密度和空间定位以及尺寸大小,对提高结合能力和细胞内化效率至关重要。生物学院博士研究生黄金是论文的第一作者。

在此项研究中,研究人员首先利用DNA纳米技术构建了三种多功能DNA单体(pH-aptDMs,包括DM1I, DM2Ior DM3I),在每个单体上同时整合了刺激响应基元(裂开型i-motif探针)、靶标识别基元(Aptamer)、粘性末端组装基元和成像、治疗功能基元(Cy5/BHQ2和化疗药物Dox)。在正常生理pH条件下,三种多功能DNA单体以荧光淬灭的单分散结构存在,且具有良好的组织通透性;当处于酸性微环境中,三种被激活的多功能DNA单体通过暴露的粘性末端组装成“三臂Aptamer纳米爪”型多价Aptamer功能化DNA纳米诊疗器件。研究人员以人肝癌细胞SMMC-7721为例,分别在细胞水平和移植瘤模型中考察了该策略的增强成像和药物递送效果。
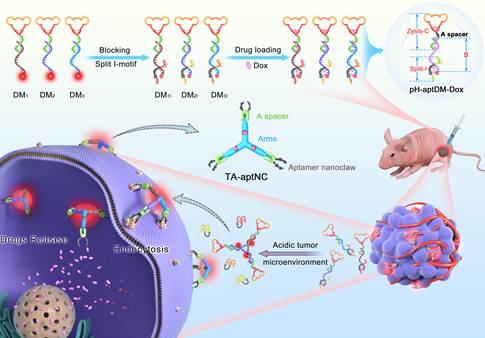
图1.肿瘤酸性微环境激活的“三臂Aptamer纳米爪”型DNA纳米诊疗器件原位组装策略用于增强肿瘤靶向成像和肿瘤生长抑制研究示意图.
研究结果表明,相比于单体而言,“三臂Aptamer纳米爪”型多价Aptamer功能化DNA纳米器件(TA-aptNC)的靶标结合亲和力提高了~2倍,识别性能和胞内药物递送效率也显著增强。在移植瘤模型考察中,TA-aptNC获得的肿瘤成像对比度分别是单价探针(pH-aptDM)和pH不敏感探针(pH-C)的1.8和3.8倍,载有Dox的TA-aptNC(TA-aptNC-Dox)活体肿瘤抑制率可达90%。在该策略中,巧妙地利用肿瘤酸性微环境驱动DNA纳米结构在肿瘤位点处的组装,实现空间选择性的增强诊疗系统靶向识别能力和细胞内化能力,有望为开发时空特异性激活的精准、高效的诊疗一体化系统提供新思路。

图2. “三臂Aptamer纳米爪”型DNA纳米诊疗器件的增强肿瘤靶向成像和肿瘤生长抑制效果.
参考文献:
Huang J, Wu Y, He H, Ma W, Liu J, Cheng H, Sun H, He X*, Wang K*. Acidic microenvironment triggered in situ assembly of activatable three-arm aptamer nanoclaw for contrast-enhanced imaging and tumor growth inhibition in vivo. Theranostics 2022; 12 (7): 3474-3487.
原文链接:https://www.thno.org/v12p3474.htm
