近日,湖南大学刘选明教授和林建中副教授团队在国际顶尖植物学期刊The Plant Cell在线发表题为“The Protein Phosphatase PC1 Dephosphorylates and Deactivates CatC to Negatively Regulate H2O2Homeostasis and Salt Tolerance in Rice”的研究论文。在该论文中,作者从水稻中鉴定了一个过氧化氢酶C(CatC)的蛋白质磷酸酶,并命名为PC1(Phosphatase of Catalase 1)。作者发现PC1能特异性去磷酸化CatC的Ser-9,促进CatC高活性四聚体解聚为低活性单体,并作为平衡耐盐和生长发育的分子开关而负调控水稻的耐盐性。

盐胁迫是限制全球粮食作物生产的主要非生物胁迫之一。据统计,全世界约有9.3亿hm2的土地遭受盐渍化,约20%的灌溉土地受到盐渍化影响,其中我国的土壤盐渍化面积大约有3600万hm2,严重限制着我国粮食生产。因此,发掘重要耐盐碱基因和培育耐盐碱作物是保障粮食安全的重要举措。过氧化氢酶(CAT)是一种过氧化氢(H2O2)的清除酶,在胁迫响应和生长发育中发挥核心作用。CAT作为一种磷酸化蛋白,其功能受到磷酸化修饰的严格调节。已有数个激酶被报道通过磷酸化CAT而激活其活性,而磷酸酶去磷酸化CAT却未见报道。作者通过免疫沉淀-质谱方法从水稻CatC的复合体中鉴定了一个蛋白质磷酸酶PC1,发现PC1和CatC在过氧化物酶体中相互作用,并特异性地将CatC的Ser-9去磷酸化而下调其酶活性。凝胶色谱分析发现,模拟磷酸化的CatCS9D四聚体状态显著高于模拟去磷酸化的CatCS9A,说明PC1去磷酸化CatC主要促进高活性的CatC四聚体解聚为低活性的单体,从而抑制其酶活性。蛋白结构分析发现,带负电荷的磷酸化Ser-9能够结合到CatC四聚体结构表面的一个正电荷聚集中心,从而稳定其四聚体结构。表型分析发现,PC1过表达株系对盐和氧化胁迫敏感,且积累较多的H2O2;pc1敲除突变体则对盐和氧化胁迫的耐受性显著提高,H2O2积累降低,表明PC1通过调控H2O2稳态而负调控水稻对盐和氧化胁迫的耐受性。同时还发现,pc1突变体能显著降低因盐胁迫造成的产量损失,在耐盐水稻培育中具有潜在应用价值(图1)。
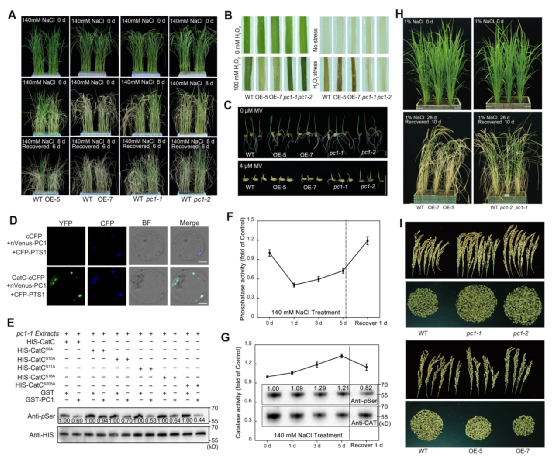
图1. PC1通过去磷酸化CatC负调控水稻体内H2O2稳态和耐盐性
通过种子根和酶活性分析发现,PC1在水稻由耐盐至正常生长发育状态的转变过程中起着重要的调控作用。遭受盐胁迫时,磷酸酶PC1活性被抑制,相关激酶被激活,在质膜的胞质侧磷酸化CatC,并转移至过氧化物酶体形成四聚体,抑制细胞内H2O2的积累,消除氧化损伤,提高水稻耐盐性;解除盐胁迫时,激酶活性被抑制,磷酸酶PC1活性升高,在过氧化物酶体中去磷酸化CatC的Ser-9,促进CatC四聚体的解聚及活性下调,维持细胞内合适H2O2含量(作为信号分子),促进水稻正常生长发育(图2)。该论文中所鉴定的PC1为解析CAT如何去磷酸化而关闭的分子机制提供了可能,并且PC1作为CAT活性响应盐胁迫的分子开关而参与耐盐和正常生长发育平衡的调控,同时也为培育耐盐水稻提供了新的策略。The Plant Cell将该论文选为亮点文章,并专门撰写了题为“Molecular switch to regulate salt-tolerance in rice”的推送文章。有趣的是,研究团队先前解析了一个类受体胞质激酶STRK1磷酸化CatC而正调控水稻耐盐性的分子机制,也作为亮点文章发表(Zhou et al., Plant Cell, 2018)。激酶STRK1和磷酸酶PC1功能的先后解析较为完整地揭示了CAT受可逆磷酸化调控的分子开关作用机制。
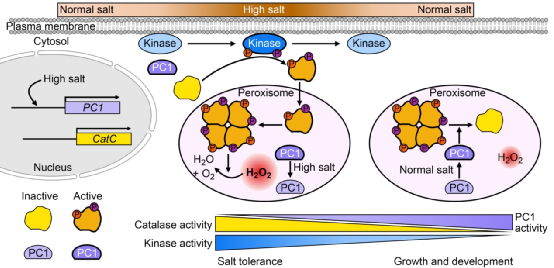
图2. PC1调控水稻耐盐和生长发育平衡的工作模式图
刘聪博士后和林建中副教授为该论文的共同第一作者;刘选明教授和林建中副教授为共同通讯作者。袁隆平农业高科技股份有限公司杨远柱研究员团队、湖南大学郑和平教授、吉林大学左泽乘教授、北京大学何航教授和湖南农业科学院柏连阳院士也参与完成了部分研究工作。该研究得到了国家自然科学基金、湖南省重大科技专项、湖南省自然科学基金等经费的资助,同时也得到了国家耐盐碱水稻技术创新中心、杂交水稻国家重点实验室、广西水稻遗传育种重点实验室和海南省崖州湾种子实验室的大力支持。
论文链接:https://doi.org/10.1093/plcell/koad167
